ÓXIDOS from Roko Domo Lds
lunes, 25 de noviembre de 2013
jueves, 21 de noviembre de 2013
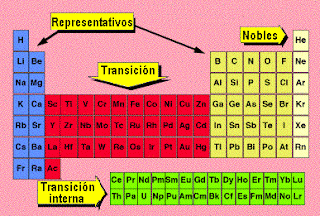
ELEMENTOS REPRESENTATIVOS DE LA TABLA PERIODICA
La tabla periódica de los elementos clasifica, organiza y distribuye los distintos elementos químicos conforme a sus propiedades y características; su función principal es establecer un orden específico agrupando elementos.
Suele atribuirse la tabla a Dmitri Mendeléyev, quien ordenó los elementos basándose en las propiedades químicas de los elementos,si bien Julius Lothar Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las propiedades físicas de los átomos. La estructura actual fue diseñada por Alfred Werner a partir de la versión de Mendeléyev. En 1952, el científico costarricense Gil Chaverri (1921-2005) presentó una nueva versión basada en la estructura electrónica de los elementos, la cual permite colocar las series lantánidos y los actínidos en una secuencia lógica de acuerdo con su número atómico.
En química y física atómicas, los elementos representativos o elementos de los grupos principales son elementos químicos de los grupos largos de la tabla periódica, encabezados por los elementos hidrógeno, berilio, boro, carbono, nitrógeno, oxígeno, flúor y helio, tal como aparecen en la tabla periódica de los elementos. Se caracterizan por presentar configuraciones electrónicas "externas" en su estado fundamental que van desde ns1 hasta ns2np6, a diferencia de los elementos de transición y de los elementos de transición interna.
Los elementos representativos son los elementos de los grupos 1 y 2 (bloque s), y de los grupos de 13 a 17 (bloque p).Hasta hace unos años, estos grupos se identificaban con números romanos del I al VII con la letra A. Los elementos del grupo 12 son generalmente considerados como metales de transición, sin embargo, el zinc (Zn), el cadmio (Cd), y el mercurio (Hg) comparten algunas propiedades de ambos grupos, y algunos científicos creen que deben ser incluidos como elementos representativos o elementos de los grupos principales.
Suele atribuirse la tabla a Dmitri Mendeléyev, quien ordenó los elementos basándose en las propiedades químicas de los elementos,si bien Julius Lothar Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las propiedades físicas de los átomos. La estructura actual fue diseñada por Alfred Werner a partir de la versión de Mendeléyev. En 1952, el científico costarricense Gil Chaverri (1921-2005) presentó una nueva versión basada en la estructura electrónica de los elementos, la cual permite colocar las series lantánidos y los actínidos en una secuencia lógica de acuerdo con su número atómico.
En química y física atómicas, los elementos representativos o elementos de los grupos principales son elementos químicos de los grupos largos de la tabla periódica, encabezados por los elementos hidrógeno, berilio, boro, carbono, nitrógeno, oxígeno, flúor y helio, tal como aparecen en la tabla periódica de los elementos. Se caracterizan por presentar configuraciones electrónicas "externas" en su estado fundamental que van desde ns1 hasta ns2np6, a diferencia de los elementos de transición y de los elementos de transición interna.
Los elementos representativos son los elementos de los grupos 1 y 2 (bloque s), y de los grupos de 13 a 17 (bloque p).Hasta hace unos años, estos grupos se identificaban con números romanos del I al VII con la letra A. Los elementos del grupo 12 son generalmente considerados como metales de transición, sin embargo, el zinc (Zn), el cadmio (Cd), y el mercurio (Hg) comparten algunas propiedades de ambos grupos, y algunos científicos creen que deben ser incluidos como elementos representativos o elementos de los grupos principales.
SINTESIS DEL AGUA
Planteamiento
del problema:
¿Podran ser apturados los componentes del agua?
Objetivo:
Construir un modelo parala sintesis del agua, para proceder con el experimente y lograr capturar los gases en un recipiente y lograr una reaccion quimica al contacto con gas butano
Introducción:
la síntesis orgánica en aguacomprende aquellos procesos de
formación de compuestos de esqueleto hidrocarbonado que se llevan a cabo en
medio acuso, este tipo de disolventes especialmente los disolventes clorados.
Los compuestos son combinaciones químicas de los elementos y en esta práctica
realizaremos a cabo una mezcla que de como resultado agua (H2O) en esta vez en vez
de separarlos los juntaremos
Hipótesis:
Nosotros como equipo creemos que si sera posible la capturacion de dichos gases y lograr la reaccion, ya que la mayoriade los gases al contacto con gas butano producen reaccion.
Material
y sustancias:
1
manguera pequeña
1 eliminador
2 caimanes
1 botecito de mamila
1 vial pequeño
pinzas chiquitas
1 base de botella de refresco
1 tapa de jeringa
agua oxigenada
levadura de cerveza
cloruro de sodio
2 caimanes
1 botecito de mamila
1 vial pequeño
pinzas chiquitas
1 base de botella de refresco
1 tapa de jeringa
agua oxigenada
levadura de cerveza
cloruro de sodio
Procedimiento:
Se llenó
la base del refresco con agua salina, Se dividió la mamila en 3 partes y estas
se marcaron en líneas con plumón permanente
se llenó la mamila completamente con el agua salina
una vez llena la mamila se le coloco un dedo en la parte de arriba y de tal forma que al voltear no se saliera agua, se coloca la mamila boca abajo dentro del envase con agua salina y se utilizó la pinza, se agregó una porción de levadura de cerveza con agua oxigenada a un vial , después se tapó y a la tapa se le hizo un orificio de tal manera que se introdujera la manguera , se conectaron los caimanes al eliminador y se metieron los 2 caimanes a el agua y de esta forma se puso el de mayor energía adentro de la mamila se retiraron los caimanes una vez que se disminuido una tercera parte de la mamila después se metió debajo de la mamila la manguera hasta que se disminuyó totalmente el agua , después de que esta ya no tenía agua se tapó con un dedo sin dejar escapar nada y se le prendió inmediatamente fuego y se produjera una pequeña explosión
se llenó la mamila completamente con el agua salina
una vez llena la mamila se le coloco un dedo en la parte de arriba y de tal forma que al voltear no se saliera agua, se coloca la mamila boca abajo dentro del envase con agua salina y se utilizó la pinza, se agregó una porción de levadura de cerveza con agua oxigenada a un vial , después se tapó y a la tapa se le hizo un orificio de tal manera que se introdujera la manguera , se conectaron los caimanes al eliminador y se metieron los 2 caimanes a el agua y de esta forma se puso el de mayor energía adentro de la mamila se retiraron los caimanes una vez que se disminuido una tercera parte de la mamila después se metió debajo de la mamila la manguera hasta que se disminuyó totalmente el agua , después de que esta ya no tenía agua se tapó con un dedo sin dejar escapar nada y se le prendió inmediatamente fuego y se produjera una pequeña explosión
análisis del resultado:
Siguiendo estos
pasos se puede conseguir una mínima cantidad de gas hidrogeno , al igual
pudimos notar que esta reacción fue exotérmica y desprendió calor , se unen los
átomos de hidrogeno con el átomo del oxigen.
LA ELECTROLISIS DEL AGUA
Planteamiento del Problema:
Con
los materiales requeridos, tenemos que descomponer el agua en lo que son sus
componentes: oxígeno e hidrógeno por medio de una corriente eléctrica que será
introducida en el agua junto con los otros materiales.
Objetivo:
Obtener
por medio de una corriente eléctrica a través del agua el oxígeno y el
hidrógeno, donde estos gases estarán cada uno en una jeringa.
Introducción:
Para
realizar la electrolisis del agua, necesitamos una gran cantidad de energía,
para romper varias barreras de activación. Si la energía no es suficiente, el
proceso de electrolisis será muy lento y tal vez no pueda suceder. El agua
tiene una conductividad eléctrica, así
que la eficacia de la electrolisis aumenta cuando agregas un electrolito: como
la sal, un ácido o una base, y el uso de electrocatalizadores.
Hipótesis:
Creemos
que al colocar la fuente de energía eléctrica y al conectarlos con los dos
electrodos y colocar las jeringas en el agua.
Material y Sustancias:
2
Jeringas de 15 ml
1
Jeringa y 10ml
1
botella recortada a menos de la mitad
2
clips
1
cable caimán
1
batería de 12V
Procedimiento:
Hacer
dos hoyos en los extremos de las dos jeringas de 15ml y recortar por la mitad
la jeringa de 10ml de forma que pueda introducirse entre las dos jeringas.
Cortar
un pedazo de los dos clips y clavarlos en la boquilla de las dos jeringas.
Introducir
las jeringas en la botella que esta recortada y llenarla con agua y podemos
agregar ácido sulfúrico o cloruro de sodio, después conectar los cables caimán
a la batería y a los clips. En una de las partes de la jeringa el oxígeno
aparecerá en el cátodo (el electrodo negativamente cargado, donde los
electrones son bombeados al agua) y el oxígeno aparecerá en el ánodo (el
electrodo positivamente cargado). Ahí es donde comienza el desprendimiento de
gases.
Observaciones:
Observamos
que al sacar uno de los electrodos del agua, la reacción se detuvo.
También
observamos que la bureta que esta el ánodo
el volumen del gas será aproximadamente la mitad del volumen del gas de la
bureta que tiene el cátodo.
Conclusiones:
Lo que hicimos al final de la práctica fue bien
hecha, sacamos con cuidado sacar el Hidrógeno y lo sometimos a
una flama y obtuvimos una combustión. Y al sacar el Oxígeno y lo sometimos a
una flama, esta crecerá.
martes, 29 de octubre de 2013
Obtencion de Gases
Planteamiento del problema
¿podremos descubrir que gases son inflamables y cuales no?
Objetivo
Por medio de procedimientos lograremos capturar gases como son Bioxido de carbono, Oxigeno, Hidrogeno y gas butano, para posteriormente con una vara con fuego tratar de prenderlos y así ver su reacción.
Introduccion
El acetileno, el amoníaco, el hidrógeno, el propano, el propileno y el metano son gases inflamables, también conocidos como gases combustibles. Arden al mezclarse con un oxidante y si se les aporta una fuente de ignición
Hipotesis
Nosotros creemos que todos los gases explotaran al ponerlos en contacto con el fuego, por que tenemos un pensamiento que todos estos gases son inflamables.
Material y reactivos
1 gradilla
4 tubos de ensayo
1 encendedor
4 globos
Alkalzeltzer
Agua
Peróxido de hidrogeno
Levadura de cerveza
Aluminio
Acido clorhídrico
Gas butano
Procedimiento
1Para la obtencio del Bioxido de carbono (CO2), en un tubo de ensayo colocaremos un poco de agua y posteriormente en uno de los globos añadiremos ¼ de alkalzeltzer para después vertirlo dentro del tubo de ensayo que contiene agua, para finalizar colocaremos la boquilla del globo en la boquilla del tubo para así poder observar como se mezclan estos materiales y observar su reacción capturando así el gas de bióxido de carbono, haciendo inmediatamente un nudo para no dejar escapar el gas y poner de un lado.
2 Para la obtención de Oxigeno (O2), en un tubo de ensayo vertiremos 3ml de agua oxigenada (H2O2) para después en el globo colocar un poco de levadura de cerveza y así nuevamente colocar la boquilla del globo en la boquilla del tubo y dejar que se mezclen, por ultimo retirar el globo no sin antes hacer un nudo y dejar a un lado.
3 Obtencion de Hidrogeno, en otro tubo de ensayo coloca de 8 a 10 pedacitos de aluminio y en el mismo tubo añadir acido clorhídrico poner inmediatamente el globo en la boquilla del tubo y esperar a que se concentre el gas dentro de el, retirarlo y hacer el nudo, dejarlo a un lado.
4 Obtencion de butano (C4H10), Para este gas lo único que tenemos que hacer es colocar la boquilla de un globo en un isopo
Para finalizar con precaucion sacaremos los globos con el gas y los pondremos en un lugar seguro para así debajo de ellos poner fuego para observar cuales de los gases que tenemos son inflamables
Conclusión
Nos pudimos dar cuenta que todos los gases excepto el gas butano hicieron una pequeña explosión, esto nos da a entender que todos los gases son inflamables.
¿podremos descubrir que gases son inflamables y cuales no?
Objetivo
Por medio de procedimientos lograremos capturar gases como son Bioxido de carbono, Oxigeno, Hidrogeno y gas butano, para posteriormente con una vara con fuego tratar de prenderlos y así ver su reacción.
Introduccion
El acetileno, el amoníaco, el hidrógeno, el propano, el propileno y el metano son gases inflamables, también conocidos como gases combustibles. Arden al mezclarse con un oxidante y si se les aporta una fuente de ignición
Hipotesis
Nosotros creemos que todos los gases explotaran al ponerlos en contacto con el fuego, por que tenemos un pensamiento que todos estos gases son inflamables.
Material y reactivos
1 gradilla
4 tubos de ensayo
1 encendedor
4 globos
Alkalzeltzer
Agua
Peróxido de hidrogeno
Levadura de cerveza
Aluminio
Acido clorhídrico
Gas butano
Procedimiento
1Para la obtencio del Bioxido de carbono (CO2), en un tubo de ensayo colocaremos un poco de agua y posteriormente en uno de los globos añadiremos ¼ de alkalzeltzer para después vertirlo dentro del tubo de ensayo que contiene agua, para finalizar colocaremos la boquilla del globo en la boquilla del tubo para así poder observar como se mezclan estos materiales y observar su reacción capturando así el gas de bióxido de carbono, haciendo inmediatamente un nudo para no dejar escapar el gas y poner de un lado.
2 Para la obtención de Oxigeno (O2), en un tubo de ensayo vertiremos 3ml de agua oxigenada (H2O2) para después en el globo colocar un poco de levadura de cerveza y así nuevamente colocar la boquilla del globo en la boquilla del tubo y dejar que se mezclen, por ultimo retirar el globo no sin antes hacer un nudo y dejar a un lado.
3 Obtencion de Hidrogeno, en otro tubo de ensayo coloca de 8 a 10 pedacitos de aluminio y en el mismo tubo añadir acido clorhídrico poner inmediatamente el globo en la boquilla del tubo y esperar a que se concentre el gas dentro de el, retirarlo y hacer el nudo, dejarlo a un lado.
4 Obtencion de butano (C4H10), Para este gas lo único que tenemos que hacer es colocar la boquilla de un globo en un isopo
Para finalizar con precaucion sacaremos los globos con el gas y los pondremos en un lugar seguro para así debajo de ellos poner fuego para observar cuales de los gases que tenemos son inflamables
Conclusión
Nos pudimos dar cuenta que todos los gases excepto el gas butano hicieron una pequeña explosión, esto nos da a entender que todos los gases son inflamables.
domingo, 29 de septiembre de 2013
Bandera de México
OBJETIVO:
El objetivo de esta práctica es hacer la bandera de México solamente con agua ,azúcar ,colorante y leche. Saber la densidad que debe tener cada Parte del agua para que estas no se mezclen y así cada una tener el color indicado.
El objetivo de esta práctica es hacer la bandera de México solamente con agua ,azúcar ,colorante y leche. Saber la densidad que debe tener cada Parte del agua para que estas no se mezclen y así cada una tener el color indicado.
MATERIAL:
*agua (cantidad necesaria).
*Colorante artificial.
*azúcar (cantidad necesaria).
*Leche.
PROCEDIMIENTO:
En primer lugar en un vaso se vierte 30 ml de agua con 8 cucharadas de azúcar estas se mezclan hasta que se haya disuelto el azúcar y se le agrega 2 gotas de colorante rojo.
En segundo lugar en un vaso se invierte 30 ml de leche con 4 ½ cucharadas de azúcar estas se mezclan y se invierte con la otra cantidad que ya teníamos anteriormente (mezcla roja) poco a poco para que estas no se mezclen.
En tercer lugar en un vaso se invierte 30 ml de agua con 2 cucharadas de azúcar estas se mezclan y se le agrega 2 gotas de colorante verde. Esta se invierte en el vaso con las otras 2 cantidades poco a poco para que no se mezclen.
OBSERVACIONES:
al mezclar las sustancias estas son propensas a fusionarse , debido a esto la inyección de dicha sustancia debió ser o debe ser lenta y cuidadosamente, ya que si no estás propasan la sustancia ya adquirida en el recipiente y pasa a fusionarse.
Las medidas de adquisición de sustancia deben ser si no exactas precisas para la buena compostura de dicha sustancia.
CONCLUSIÓN:
Al termino de esto y debido al buen manejo de sustancia (ya sea medida en gramos o mililitros)la consistencia de las 3 sustancias es apta en resumen a las exactas medidas tomadas difundiéndose a la tercera y última mezcla , fue a desnivel en una complexión mínima debido a que el líquido ya insertado en el recipiente era basto para un descontrol
martes, 24 de septiembre de 2013
Problemas de Disolucion
1-.¿Quién ingiere más alcohol? una persona A que toma una cerveza cuyo volumen es de 355 mL y su porcentaje de alcohol en volumen es de 5.3 ó la persona B que toma una copa de Ron cuyo volumen es de 35 mL y su concentración de alcohol es del 39 % en volumen.
FORMULA:
Vsoluto= %V x Vdisolucion
100
DATOS PERSONA A:
%V= 5.3%
Vdisolucion= 355ml
Vsoluto= ¿
SUSTITUCION PERSONA A :
Vsoluto=5.3 x 355 = 18.815 soluto
100
DATOS PERSONA B:
%V= 39%
Vdisolucion= 35ml
Vsoluto=?
SUSTITUCION PERSONA B:
Vsoluto= 39% x 35ml = 13.65 soluto
100
R= LA PERSONA ‘’A’’ INGIERE MÁS ALCOHOL.
2-.¿Cuántos gramos de solución al 15% de NaCl se necesita para extraer 38g de cloruro de sodio evaporando el agua?
FORMULA:
Msoluto= %M x Mdisolucion
100
DATOS:
Msoluto= 15%
Mdisolucion= 38g
%M?
SUSTITUCION:
Msoluto= 15 x 38 = 5.7
100
RESULTADO: 5.7g
3.-¿Cuántos gramos de ácido clorhídrico concentrado que tiene una concentración del 37,9% de HCl en peso se requiere para disponer de 5g de HCl puro?
DATOS:
% de masa= 37.9
Masa de disolución= 5g
Masa de soluto= ?
FORMULA:
Masa de soluto= %masa x mdisolucion
100
SUSTITUCION:
37.9 x 5 = 1.8
100
RESULTADO: 1.8g de acido clorhídrico
4.-Se necesita preparar 250g de solución de NaOH al 19,7% en peso. ¿Cuántos gramos de NaOH y agua se necesitan?
DATOS:
M.disolucion=250g
% de masa 19.7
FORMULA:
M.soluto= % masa x M.disolucion
100
SUSTITUCION
M.soluto= 19.7 x 250 = 49.25
100
FORMULA 2:
M.disolucion= M.soluto x 100
% masa
SUSTITUCION:
M.disolucion= 49.25 x 100
19.7
RESULTADO:
se necesita 250g de agua y 49.25g de NaOH.
5.-¿Cuál es la concentración porcentual de la solución que contiene 85g de H2SO4 en 500 g de solución?
DATOS:
Msoluto= 85
Mdisolucion= 500g
%M=?
FORMULA:
%M = Msoluto x 100
M disolucion
SUSTITUCION:
%M= 85 x 100 = 17
500
RESULTADO:
17%
6.-¿Con qué cantidad de agua deben diluirse 40g de ácido nítrico para obtener una solución al 5% en peso de dicha sustancia?
DATOS:
40g acido nítrico
5% de peso
FORMULA:
M.disolucion= M.soluto x 100
% masa
SUSTITUCION:
M.disolucion= 40 x 100 = 800
5
RESULTADO: 800g de agua se necesitan para diluir
7.-Cuando se evaporan 50 g de solución de sulfato de sodio (Na2SO4) hasta sequedad, se producen 20 g de sal; ¿Cuál es el % de sal en la solución?
DATOS:
M.soluto= 20g
M.disolucion=50g
% Masa=?
FORMULA:
%masa= M.soluto x 100
M. disolucion
SUSTITUCION:
% masa = 20 x 100 = 40
50
RESULTADO:
40%
8.-Si se disuelven 20 mL de alcohol en 80 mL de agua, ¿Cuál es el % de alcohol en la solución?
DATOS:
M. soluto = 20g
M. disolucion = 80
% M = ?
FORMULA:
%m = M. soluto x 100
M. disolucion
SUSTITUCION:
%m = 20 x 100 = 25
80
RESULTADO:
25%
9.-¿Cuántos g de NaOH se necesitan para preparar 200 g de una solución al 10% de NaOH?
DATOS:
%m = 10%
M. disolucion= 200 g
M. soluto = ?
FORMULA:
M.soluto = %m x M. disolucion
100
SUSTITUCION:
M. soluto = 10 x 200
100
RESULTADO:
2Og
10.-Si 30 g de azúcar se disuelven en 100 g de agua, ¿Cuál es el % de azúcar en la solución?
DATOS:
M. soluto = 30 g
M. disolucion = 100 g
%M = ?
FORMULA:
% m = M. soluto x 100
M. disolucion
SUSTITUCION:
%M = 30 x 100
100
RESULTADO:
30 %
11.-Determina el % en peso de una solución preparada con 20 g de KCl en 200 g de agua.
DATOS:
M. soluto = 20 g
M. disolucion = 200 g
% M. = ?
FORMULA:
% M = M. soluto x 100
M.disolucion
SUSTITUCION:
%M= 20g x 100
200
RESULTADO:
10 %
12.-Deseamos preparar 600 g de solución con una concentración al 5%, calcula que cantidad de soluto se necesita.
DATOS:
%M = 5 %
M. disolucion = 600 g
M. soluto= ?
FORMULA:
M. soluto = %M x M. disolucion
100
SUSTITUCION:
M. soluto = 5 x 600
100
RESULTADO:
30 M. soluto
13.-¿Cuál es el % en peso de una solución que se ha preparado disolviendo 15 g de NaCl en 150 g de agua?
DATOS:
M. soluto = 15g
M. disolucion = 150g
%M= ?
FORMULA:
%M = M. soluto x 100
M. Disolucion
SUSTITUCION:
%M = 15 x 100
150
RESULTADO:
10 %M
14.-¿Qué % en masa resultará al disolver 20 g de sal de mesa en 100 g de agua? ¿Cuántos g de una solución al 12.5% en masa de nitrato de plata (AgNO3) contienen 350 g de solución?
DATOS:
M. soluto = 20 g
M. disolucion = 100g
% M = ?
FORMULA:
%M = M. soluto x 100
M. disolucion
SUSTITUCION:
%M = 20g x 100
100
RESULTADO:
20 % M
DATOS:
%M = 12.5 %
M. disolucion = 350 g
M. soluto= ?
FORMULA:
M. soluto = %M x M.disolucion
100
RESULTADO:
43.75
15.-¿Cuántos mL de H2S se necesitan para preparar 150 mL de solución al 3%?
DATOS:
%M = 3%
M.disolucion= 150 ml
M. soluto= ?
FORMULA:
M. soluto = %M x M. disolucion
100
SUSTITUCION:
M. soluto = 3 x 150
100
RESULTADO:
4.5 M. soluto
CUESTIONARIO
1-.¿Qué diferencia hay entre un cambio físico y un cambio químico?
La diferencia fundamental entre los cambios físicos y químicos radica en que en los primeros no se forman nuevas sustancias, mientras que en los segundos sí, como en el ejemplo de la oxidación del magnesio. En un cambio químico la energía desprendida o absorbida es mayor que en el caso del cambio físico
2. ¿Por qué se afirma que en un cambio químico hay una reordenación de átomos? Emplea un ejemplo para tu explicación.
Durante la síntesis del agua los elemento hidrógeno y oxígeno sufrieron cambios en su estructura, las moléculas de hidrógeno y oxígeno se rompen, sufren un cambio, y se reacomodan para formar nuevamente agua. En ambos casos, no hay átomos que provengan de otra parte y tampoco sobra o falta ningún átomo. Estos cambios, el análisis (electrólisis) y la síntesis del agua, son cambios químicos
La diferencia fundamental entre los cambios físicos y químicos radica en que en los primeros no se forman nuevas sustancias, mientras que en los segundos sí, como en el ejemplo de la oxidación del magnesio. En un cambio químico la energía desprendida o absorbida es mayor que en el caso del cambio físico
2. ¿Por qué se afirma que en un cambio químico hay una reordenación de átomos? Emplea un ejemplo para tu explicación.
Durante la síntesis del agua los elemento hidrógeno y oxígeno sufrieron cambios en su estructura, las moléculas de hidrógeno y oxígeno se rompen, sufren un cambio, y se reacomodan para formar nuevamente agua. En ambos casos, no hay átomos que provengan de otra parte y tampoco sobra o falta ningún átomo. Estos cambios, el análisis (electrólisis) y la síntesis del agua, son cambios químicos
3-.¿Por qué se afirma que en un cambio físico se cumple la ley de la conservación de la materia? Emplea un ejemplo para tu explicación
. En los cambios como la congelación o la evaporación del agua solo se altera su tamaño, forma o estado físico, pero no su estructura o composiciónno implican transformación atómico-molecular de la materia, por ejemplo la dilatación del mercurio contenido en un termómetro o de un trozo de metal expuesto al calor
4-. ¿Por qué se afirma que en un cambio químico se cumple la ley de la conservación de la materia? Emplea un ejemplo para tu explicación.
Establece que, la materia no se crea ni se destruye solo se transforma. Un ejemplo de esto es la evaporación del agua
5. Al llevarse a cabo un cambio, qué evidencias permiten afirmar que fue un cambio químico. Explica cada una.
Se permite afirmar que fue un cambio químico cuando las sustancias pierden sus propiedades y se forman otras con propiedades diferentes, para ver distintas propiedades nos basamos en el punto de fusión, de ebullición, densidad, solubilidad en agua o color.
Punto de Fusión: Es el proceso por el que una sustancia sólida al calentarse se convierte en líquido.
Punto de Ebullición: Es aquella temperatura en la cual la presión de vapor del líquido iguala a la presión de vapor del medio en el que se encuentra.
Densidad: Cantidad de masa contenida en un determinado volumen de una sustancia.
Solubilidad: Es una medida de la capacidad de disolverse una determinada sustancia (soluto) en un determinado medio (solvente).
BEBIDA REFRESCANTE
PLANTEAMIENTO DEL PROBLEMA
OBJETIVO
Elaborar un refresco con las concentraciones exactas para que tenga un buen sabor el producto.
HIPÓTESIS
Nosotros creemos que con la tecnica prueba y error y haciendo nuestras anotaciones lograremos tener la bebida esperada
INTRODUCCIÓN
El soluto es la parte que se encuentra en menor cantidad y es la fase que se va dispersar en el disolvente.El disolvente es la parte que se encuentra en mayor proporción y es la fase que va dispersar o disolver
MATERIAL SUSTANCIAS
3 envases de refresco de 125 mL 300g de Azúcar2 vasos de pp. de 250 mL Bicarbonato de sodio
1 espátula Colorante natural
2 vasos de pp. de 50 mL Saborizante
1 probeta de 100 mL 500mL de Agua embotellada
1 balanza electrónica 300g Acido cítrico
PROCEDIMIENTO
1. De acuerdo a tu equipo realizar la siguiente cantidad de refresco (Disolución)EQUIPO 1---- 190g
EQUIPO 2---- 170g
EQUIPO 3 ----185g
EQUIPO 4 ----200g
EQUIPO 5 ----167g
EQUIPO 6 ----174g
2. Hacer cálculos de concentración de acuerdo a tu contenido de refresco para obtener los valores en gramos de cada uno de los siguientes sustancias (proporcionadas en %masa de soluto ) implícitas
en la formulación:
AZUCAR ----12%
ACIDO CITRICO----3%
BICARBONATO DE SODIO----2%
COLORANTE---- 0.1%
SABORIZANTE---- 0.1%
AGUA ---- 82.8%
3. Pesar por separado cada una de las sustancias en la balanza electrónica.
4. Adicionar al vaso de pp. de 250 mL. de las as sustancias ya pesadas en el siguiente orden (azúcar, acido cítrico, colorante y el saborizante)
5. Después de mezclar las sustancias agregue el agua y mezcle con un agitador.
6. Ya que tenga la mezcla vaciarla en el envase de plástico de 125ml y agregarle el bicarbonato de sodio, rápidamente cerrar la botella y agitar vigorosamente.
7. Esperar un par de minutos y abrir la botella y probar el refresco.
8. Si la bebida no cumple con las expectativas de sabor deseadas tendrá que realizar nuevamente una formulación modificando los valores en gramos de cada una de las sustancias (proporcionadas en %masa de soluto ), hasta adquirir el sabor deseado del producto
9. Por último realizar una etiqueta para cada uno de los productos la cual debe contener : Marca de la empresa, nombre del producto, ingredientes, código de barras , logotipo del producto y contenido neto)
OBSERVACIONES:
Al agregar mucho bicarbonato de sodio notamos que a comparación de la primera bebida que agregamos un poco menos cambiaba mucho el sabor, asi que decidimos que disminuiríamos la cantidad.Lo que necesitamos en nuestra ultima botella era un poco mas de Saborizante para llegar a un buen sabor de refresco.
RESULTADOS
CONCLUSIONES:
Al hacer nuestra primera botella de refresco y al probarla notamos que tenía demasiada azúcar, así que llegamos a un punto donde 2.3 eran buenas cantidades para el azúcar. El ingrediente que mas vario en las cantidades fue el bicarbonato de sodio porque al principio de nuestro experimento agregamos demasiado así que a la tercera botella agregamos una pequeña cantidad. Al terminar con nuestro proyecto llegamos a la conclusión de que la tercer botella fue la que resulto con un mejor sabor ya que reducimos el azúcar, disminuimos el bicarbonato y el acido cítrico y aumentamos ligeramente el saborizante a como estaba en la primer botella.
BIBLIOGRAFIA:
http://www.experimentoscaseros.info/2012/07/como-hacer-tu-propio-refresco-con-gas.html
CUESTIONARIO
¿Qué se forma al juntar todas las sustancias solutos y disolventes?
Se forma una mezcla homogénea
¿Cuál es la sustancia que le da el sabor al refresco?
El Saborizante y el Cítrico
¿Qué efecto tiene el bicarbonato de sodio en la bebida?
Que al agitarla produce mucho gas y hace que el refresco salga de la botella
¿Qué tipo de cálculos se tienen que realizar para obtener en gramos cada una de las sustancias?
Usando formulas para sacar el porcentaje de masa, soluto, disolución etc. Son simples multiplicaciones y divisiones
¿Qué efecto tiene cada una de las sustancias en esta bebida?
Que cada sustancia tiene características en especial para darle color, sabor, olor al refresco gracias a los químicos y cantidades que agregamos a la mezcla.
viernes, 6 de septiembre de 2013
EXAMEN DE DIAGNOSTICO
EXAMEN
DIAGNÓSTICO PARA QUÍMICA I
Instrucción: Escribe dentro del
paréntesis la letra de la opción correcta.
1.( b ) Una mezcla:
a)Puede separarse por métodos
físicos
b)Es químicamente pura
c)Solo puede separarse por
métodos químicos
d)Siempre esta en proporciones
constantes
2. (a ) Es una característica de
las mezclas heterogéneas:
a)Sus componentes no se
distinguen
b)Las disoluciones son ejemplos
de ellas
c)Se presentan en una sola fase
d)Se presentan en dos o más fases
3. ( a) El disolvente en una
disolución es el componente que:
a)Se encuentra en mayor
proporción
b)No se disuelve
c)Se encuentra en mayor
proporción
d)Se retiene en el papel filtro
4. ( a) Resuelve el siguiente
problema
¿Cuál es el porcentaje en masa de
5g de azúcar disueltos
en 20 g de agua destilada?
a)25 %
b)20 %
c)85 %
d)95 %
5. ( b) Sustancias puras que se
forman por combinación química de dos o más elementos:
a)Mezcla homogénea
b)Compuesto
c)Mezcla heterogénea
d)Elemento
6. ( b) La expresión H2O representa:
a) los símbolosde doselementos
b) la fórmula química deun
compuesto
c) la proporción de elementos en
una mezcla
d) la posición del soluto y el
disolvente en una disolución
7. ( b) Es una característica de
los compuestos:
a)Están constituidos por un solo
tipo de átomos.
b)No se pueden descomponer en
sustancias más simples.
c)A partir de ellos, se derivan
todas las demás sustancias.
d)Constituidos por dos o más
tipos de átomos unidos en una proporción fija.
8. Relación de columnas. Escribe
dentro del paréntesis el inciso que corresponda al grupo de sustancias al que
pertenece cada ejemplo:
A)Ácido
B) Hidróxido Ácido
( c) HCL
C) Óxido ácido o anhídrido ( b ) AL(OH)3
D) Oxido básico o metálico ( d ) FeO
( a ) CO2
9. ( b) Sustancia pura cuyos átomos constituyentes
son del mismo tipo:
a)mezcla
b)elemento
c)compuesto
d)disolución
10. ( c ) Sustancia que no puede
descomponerse en otra más simple por métodos químicos:
a)mezcla
b)compuesto
c)elemento
d)disolución
11. ( b ) Las representaciones
Na, Cu, Al, Fe o Pb, corresponden a:
a)Fórmulas químicas
b)Símbolos químicos
c)Nombres de elementos
d)Nombres de compuestos
12. ( d) En el lenguaje de la
química, los elementos se representan por medio de su:
a)Estado físico
b)Masa atómica
c)Número atómico
d)Símbolo químico
14. Relación de columnas. De los
siguientes fenómenos cuáles son físicos (F) o químicos(Q).
( F) Quemar una hoja de papel
( Q) Hervir agua
F) Fisicos
(F ) Hacer agua de limón Q) Quimicos
(F ) La oxidación de láminas metálicas
15. Relación de columnas.
Con base en el concepto de átomo,
completa las siguientes frases:
(A)Partículas que presentan carga
eléctrica negativa
(D )Partículas fundamentales del
átomo con carga positiva Electrones
( C ) Nombre que recibe el número de protones en
el núcleo
( B ) Fuerza que mantiene unidos a los átomos y
moléculas tones
(A) Electrones
(B) Enlace químico
(C) Número atómico
(D) Protones.
COLLAGE EL AGUA
MAPA CONCEPTUAL
Suscribirse a:
Entradas (Atom)