ÓXIDOS from Roko Domo Lds
CCH NAUCALPAN
lunes, 25 de noviembre de 2013
jueves, 21 de noviembre de 2013
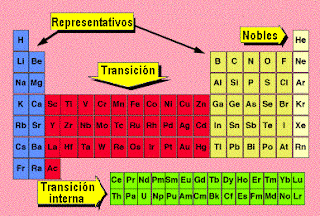
ELEMENTOS REPRESENTATIVOS DE LA TABLA PERIODICA
La tabla periódica de los elementos clasifica, organiza y distribuye los distintos elementos químicos conforme a sus propiedades y características; su función principal es establecer un orden específico agrupando elementos.
Suele atribuirse la tabla a Dmitri Mendeléyev, quien ordenó los elementos basándose en las propiedades químicas de los elementos,si bien Julius Lothar Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las propiedades físicas de los átomos. La estructura actual fue diseñada por Alfred Werner a partir de la versión de Mendeléyev. En 1952, el científico costarricense Gil Chaverri (1921-2005) presentó una nueva versión basada en la estructura electrónica de los elementos, la cual permite colocar las series lantánidos y los actínidos en una secuencia lógica de acuerdo con su número atómico.
En química y física atómicas, los elementos representativos o elementos de los grupos principales son elementos químicos de los grupos largos de la tabla periódica, encabezados por los elementos hidrógeno, berilio, boro, carbono, nitrógeno, oxígeno, flúor y helio, tal como aparecen en la tabla periódica de los elementos. Se caracterizan por presentar configuraciones electrónicas "externas" en su estado fundamental que van desde ns1 hasta ns2np6, a diferencia de los elementos de transición y de los elementos de transición interna.
Los elementos representativos son los elementos de los grupos 1 y 2 (bloque s), y de los grupos de 13 a 17 (bloque p).Hasta hace unos años, estos grupos se identificaban con números romanos del I al VII con la letra A. Los elementos del grupo 12 son generalmente considerados como metales de transición, sin embargo, el zinc (Zn), el cadmio (Cd), y el mercurio (Hg) comparten algunas propiedades de ambos grupos, y algunos científicos creen que deben ser incluidos como elementos representativos o elementos de los grupos principales.
Suele atribuirse la tabla a Dmitri Mendeléyev, quien ordenó los elementos basándose en las propiedades químicas de los elementos,si bien Julius Lothar Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las propiedades físicas de los átomos. La estructura actual fue diseñada por Alfred Werner a partir de la versión de Mendeléyev. En 1952, el científico costarricense Gil Chaverri (1921-2005) presentó una nueva versión basada en la estructura electrónica de los elementos, la cual permite colocar las series lantánidos y los actínidos en una secuencia lógica de acuerdo con su número atómico.
En química y física atómicas, los elementos representativos o elementos de los grupos principales son elementos químicos de los grupos largos de la tabla periódica, encabezados por los elementos hidrógeno, berilio, boro, carbono, nitrógeno, oxígeno, flúor y helio, tal como aparecen en la tabla periódica de los elementos. Se caracterizan por presentar configuraciones electrónicas "externas" en su estado fundamental que van desde ns1 hasta ns2np6, a diferencia de los elementos de transición y de los elementos de transición interna.
Los elementos representativos son los elementos de los grupos 1 y 2 (bloque s), y de los grupos de 13 a 17 (bloque p).Hasta hace unos años, estos grupos se identificaban con números romanos del I al VII con la letra A. Los elementos del grupo 12 son generalmente considerados como metales de transición, sin embargo, el zinc (Zn), el cadmio (Cd), y el mercurio (Hg) comparten algunas propiedades de ambos grupos, y algunos científicos creen que deben ser incluidos como elementos representativos o elementos de los grupos principales.
SINTESIS DEL AGUA
Planteamiento
del problema:
¿Podran ser apturados los componentes del agua?
Objetivo:
Construir un modelo parala sintesis del agua, para proceder con el experimente y lograr capturar los gases en un recipiente y lograr una reaccion quimica al contacto con gas butano
Introducción:
la síntesis orgánica en aguacomprende aquellos procesos de
formación de compuestos de esqueleto hidrocarbonado que se llevan a cabo en
medio acuso, este tipo de disolventes especialmente los disolventes clorados.
Los compuestos son combinaciones químicas de los elementos y en esta práctica
realizaremos a cabo una mezcla que de como resultado agua (H2O) en esta vez en vez
de separarlos los juntaremos
Hipótesis:
Nosotros como equipo creemos que si sera posible la capturacion de dichos gases y lograr la reaccion, ya que la mayoriade los gases al contacto con gas butano producen reaccion.
Material
y sustancias:
1
manguera pequeña
1 eliminador
2 caimanes
1 botecito de mamila
1 vial pequeño
pinzas chiquitas
1 base de botella de refresco
1 tapa de jeringa
agua oxigenada
levadura de cerveza
cloruro de sodio
2 caimanes
1 botecito de mamila
1 vial pequeño
pinzas chiquitas
1 base de botella de refresco
1 tapa de jeringa
agua oxigenada
levadura de cerveza
cloruro de sodio
Procedimiento:
Se llenó
la base del refresco con agua salina, Se dividió la mamila en 3 partes y estas
se marcaron en líneas con plumón permanente
se llenó la mamila completamente con el agua salina
una vez llena la mamila se le coloco un dedo en la parte de arriba y de tal forma que al voltear no se saliera agua, se coloca la mamila boca abajo dentro del envase con agua salina y se utilizó la pinza, se agregó una porción de levadura de cerveza con agua oxigenada a un vial , después se tapó y a la tapa se le hizo un orificio de tal manera que se introdujera la manguera , se conectaron los caimanes al eliminador y se metieron los 2 caimanes a el agua y de esta forma se puso el de mayor energía adentro de la mamila se retiraron los caimanes una vez que se disminuido una tercera parte de la mamila después se metió debajo de la mamila la manguera hasta que se disminuyó totalmente el agua , después de que esta ya no tenía agua se tapó con un dedo sin dejar escapar nada y se le prendió inmediatamente fuego y se produjera una pequeña explosión
se llenó la mamila completamente con el agua salina
una vez llena la mamila se le coloco un dedo en la parte de arriba y de tal forma que al voltear no se saliera agua, se coloca la mamila boca abajo dentro del envase con agua salina y se utilizó la pinza, se agregó una porción de levadura de cerveza con agua oxigenada a un vial , después se tapó y a la tapa se le hizo un orificio de tal manera que se introdujera la manguera , se conectaron los caimanes al eliminador y se metieron los 2 caimanes a el agua y de esta forma se puso el de mayor energía adentro de la mamila se retiraron los caimanes una vez que se disminuido una tercera parte de la mamila después se metió debajo de la mamila la manguera hasta que se disminuyó totalmente el agua , después de que esta ya no tenía agua se tapó con un dedo sin dejar escapar nada y se le prendió inmediatamente fuego y se produjera una pequeña explosión
análisis del resultado:
Siguiendo estos
pasos se puede conseguir una mínima cantidad de gas hidrogeno , al igual
pudimos notar que esta reacción fue exotérmica y desprendió calor , se unen los
átomos de hidrogeno con el átomo del oxigen.
LA ELECTROLISIS DEL AGUA
Planteamiento del Problema:
Con
los materiales requeridos, tenemos que descomponer el agua en lo que son sus
componentes: oxígeno e hidrógeno por medio de una corriente eléctrica que será
introducida en el agua junto con los otros materiales.
Objetivo:
Obtener
por medio de una corriente eléctrica a través del agua el oxígeno y el
hidrógeno, donde estos gases estarán cada uno en una jeringa.
Introducción:
Para
realizar la electrolisis del agua, necesitamos una gran cantidad de energía,
para romper varias barreras de activación. Si la energía no es suficiente, el
proceso de electrolisis será muy lento y tal vez no pueda suceder. El agua
tiene una conductividad eléctrica, así
que la eficacia de la electrolisis aumenta cuando agregas un electrolito: como
la sal, un ácido o una base, y el uso de electrocatalizadores.
Hipótesis:
Creemos
que al colocar la fuente de energía eléctrica y al conectarlos con los dos
electrodos y colocar las jeringas en el agua.
Material y Sustancias:
2
Jeringas de 15 ml
1
Jeringa y 10ml
1
botella recortada a menos de la mitad
2
clips
1
cable caimán
1
batería de 12V
Procedimiento:
Hacer
dos hoyos en los extremos de las dos jeringas de 15ml y recortar por la mitad
la jeringa de 10ml de forma que pueda introducirse entre las dos jeringas.
Cortar
un pedazo de los dos clips y clavarlos en la boquilla de las dos jeringas.
Introducir
las jeringas en la botella que esta recortada y llenarla con agua y podemos
agregar ácido sulfúrico o cloruro de sodio, después conectar los cables caimán
a la batería y a los clips. En una de las partes de la jeringa el oxígeno
aparecerá en el cátodo (el electrodo negativamente cargado, donde los
electrones son bombeados al agua) y el oxígeno aparecerá en el ánodo (el
electrodo positivamente cargado). Ahí es donde comienza el desprendimiento de
gases.
Observaciones:
Observamos
que al sacar uno de los electrodos del agua, la reacción se detuvo.
También
observamos que la bureta que esta el ánodo
el volumen del gas será aproximadamente la mitad del volumen del gas de la
bureta que tiene el cátodo.
Conclusiones:
Lo que hicimos al final de la práctica fue bien
hecha, sacamos con cuidado sacar el Hidrógeno y lo sometimos a
una flama y obtuvimos una combustión. Y al sacar el Oxígeno y lo sometimos a
una flama, esta crecerá.
martes, 29 de octubre de 2013
Obtencion de Gases
Planteamiento del problema
¿podremos descubrir que gases son inflamables y cuales no?
Objetivo
Por medio de procedimientos lograremos capturar gases como son Bioxido de carbono, Oxigeno, Hidrogeno y gas butano, para posteriormente con una vara con fuego tratar de prenderlos y así ver su reacción.
Introduccion
El acetileno, el amoníaco, el hidrógeno, el propano, el propileno y el metano son gases inflamables, también conocidos como gases combustibles. Arden al mezclarse con un oxidante y si se les aporta una fuente de ignición
Hipotesis
Nosotros creemos que todos los gases explotaran al ponerlos en contacto con el fuego, por que tenemos un pensamiento que todos estos gases son inflamables.
Material y reactivos
1 gradilla
4 tubos de ensayo
1 encendedor
4 globos
Alkalzeltzer
Agua
Peróxido de hidrogeno
Levadura de cerveza
Aluminio
Acido clorhídrico
Gas butano
Procedimiento
1Para la obtencio del Bioxido de carbono (CO2), en un tubo de ensayo colocaremos un poco de agua y posteriormente en uno de los globos añadiremos ¼ de alkalzeltzer para después vertirlo dentro del tubo de ensayo que contiene agua, para finalizar colocaremos la boquilla del globo en la boquilla del tubo para así poder observar como se mezclan estos materiales y observar su reacción capturando así el gas de bióxido de carbono, haciendo inmediatamente un nudo para no dejar escapar el gas y poner de un lado.
2 Para la obtención de Oxigeno (O2), en un tubo de ensayo vertiremos 3ml de agua oxigenada (H2O2) para después en el globo colocar un poco de levadura de cerveza y así nuevamente colocar la boquilla del globo en la boquilla del tubo y dejar que se mezclen, por ultimo retirar el globo no sin antes hacer un nudo y dejar a un lado.
3 Obtencion de Hidrogeno, en otro tubo de ensayo coloca de 8 a 10 pedacitos de aluminio y en el mismo tubo añadir acido clorhídrico poner inmediatamente el globo en la boquilla del tubo y esperar a que se concentre el gas dentro de el, retirarlo y hacer el nudo, dejarlo a un lado.
4 Obtencion de butano (C4H10), Para este gas lo único que tenemos que hacer es colocar la boquilla de un globo en un isopo
Para finalizar con precaucion sacaremos los globos con el gas y los pondremos en un lugar seguro para así debajo de ellos poner fuego para observar cuales de los gases que tenemos son inflamables
Conclusión
Nos pudimos dar cuenta que todos los gases excepto el gas butano hicieron una pequeña explosión, esto nos da a entender que todos los gases son inflamables.
¿podremos descubrir que gases son inflamables y cuales no?
Objetivo
Por medio de procedimientos lograremos capturar gases como son Bioxido de carbono, Oxigeno, Hidrogeno y gas butano, para posteriormente con una vara con fuego tratar de prenderlos y así ver su reacción.
Introduccion
El acetileno, el amoníaco, el hidrógeno, el propano, el propileno y el metano son gases inflamables, también conocidos como gases combustibles. Arden al mezclarse con un oxidante y si se les aporta una fuente de ignición
Hipotesis
Nosotros creemos que todos los gases explotaran al ponerlos en contacto con el fuego, por que tenemos un pensamiento que todos estos gases son inflamables.
Material y reactivos
1 gradilla
4 tubos de ensayo
1 encendedor
4 globos
Alkalzeltzer
Agua
Peróxido de hidrogeno
Levadura de cerveza
Aluminio
Acido clorhídrico
Gas butano
Procedimiento
1Para la obtencio del Bioxido de carbono (CO2), en un tubo de ensayo colocaremos un poco de agua y posteriormente en uno de los globos añadiremos ¼ de alkalzeltzer para después vertirlo dentro del tubo de ensayo que contiene agua, para finalizar colocaremos la boquilla del globo en la boquilla del tubo para así poder observar como se mezclan estos materiales y observar su reacción capturando así el gas de bióxido de carbono, haciendo inmediatamente un nudo para no dejar escapar el gas y poner de un lado.
2 Para la obtención de Oxigeno (O2), en un tubo de ensayo vertiremos 3ml de agua oxigenada (H2O2) para después en el globo colocar un poco de levadura de cerveza y así nuevamente colocar la boquilla del globo en la boquilla del tubo y dejar que se mezclen, por ultimo retirar el globo no sin antes hacer un nudo y dejar a un lado.
3 Obtencion de Hidrogeno, en otro tubo de ensayo coloca de 8 a 10 pedacitos de aluminio y en el mismo tubo añadir acido clorhídrico poner inmediatamente el globo en la boquilla del tubo y esperar a que se concentre el gas dentro de el, retirarlo y hacer el nudo, dejarlo a un lado.
4 Obtencion de butano (C4H10), Para este gas lo único que tenemos que hacer es colocar la boquilla de un globo en un isopo
Para finalizar con precaucion sacaremos los globos con el gas y los pondremos en un lugar seguro para así debajo de ellos poner fuego para observar cuales de los gases que tenemos son inflamables
Conclusión
Nos pudimos dar cuenta que todos los gases excepto el gas butano hicieron una pequeña explosión, esto nos da a entender que todos los gases son inflamables.
domingo, 29 de septiembre de 2013
Bandera de México
OBJETIVO:
El objetivo de esta práctica es hacer la bandera de México solamente con agua ,azúcar ,colorante y leche. Saber la densidad que debe tener cada Parte del agua para que estas no se mezclen y así cada una tener el color indicado.
El objetivo de esta práctica es hacer la bandera de México solamente con agua ,azúcar ,colorante y leche. Saber la densidad que debe tener cada Parte del agua para que estas no se mezclen y así cada una tener el color indicado.
MATERIAL:
*agua (cantidad necesaria).
*Colorante artificial.
*azúcar (cantidad necesaria).
*Leche.
PROCEDIMIENTO:
En primer lugar en un vaso se vierte 30 ml de agua con 8 cucharadas de azúcar estas se mezclan hasta que se haya disuelto el azúcar y se le agrega 2 gotas de colorante rojo.
En segundo lugar en un vaso se invierte 30 ml de leche con 4 ½ cucharadas de azúcar estas se mezclan y se invierte con la otra cantidad que ya teníamos anteriormente (mezcla roja) poco a poco para que estas no se mezclen.
En tercer lugar en un vaso se invierte 30 ml de agua con 2 cucharadas de azúcar estas se mezclan y se le agrega 2 gotas de colorante verde. Esta se invierte en el vaso con las otras 2 cantidades poco a poco para que no se mezclen.
OBSERVACIONES:
al mezclar las sustancias estas son propensas a fusionarse , debido a esto la inyección de dicha sustancia debió ser o debe ser lenta y cuidadosamente, ya que si no estás propasan la sustancia ya adquirida en el recipiente y pasa a fusionarse.
Las medidas de adquisición de sustancia deben ser si no exactas precisas para la buena compostura de dicha sustancia.
CONCLUSIÓN:
Al termino de esto y debido al buen manejo de sustancia (ya sea medida en gramos o mililitros)la consistencia de las 3 sustancias es apta en resumen a las exactas medidas tomadas difundiéndose a la tercera y última mezcla , fue a desnivel en una complexión mínima debido a que el líquido ya insertado en el recipiente era basto para un descontrol
Suscribirse a:
Entradas (Atom)